অম্ল-ক্ষার বিক্রিয়া হল একটি রাসায়নিক বিক্রিয়া যা অম্ল ও ক্ষারের মধ্যে ঘটে থাকে । এটি পিএইচ নির্ধারণ করতে ব্যবহার করা যেতে পারে। বেশকিছু তাত্ত্বিক কাঠামো বিক্রিয়া কৌশল এবং তাদের প্রয়োগের মাধ্যমে সমস্যা সমাধানের বিকল্প ধারণা প্রদান করে ; এগুলিকে অম্ল-ক্ষার তত্ত্ব বলা হয়, উদাহরণস্বরূপ, ব্রনস্টেড-লাউরি অম্ল-ক্ষার তত্ত্ব ।
গ্যাসীয় বা তরল অবস্থার অম্ল-ক্ষার বিক্রিয়া বিশ্লেষণে অথবা যখন অম্ল ক্ষার ধর্ম স্পষ্টরূপে বোঝা সম্ভব হয়ে ওঠে না তখন তাদের গুরুত্ব স্পষ্ট হয়ে ওঠে । এই ধারণাগুলির মধ্যে প্রথমটি ফরাসি রসায়নবিদ অ্যান্টনি ল্যাভয়সিয়ে আনুমানিক ১৭৭৬ সালে প্রদান করেছিলেন।
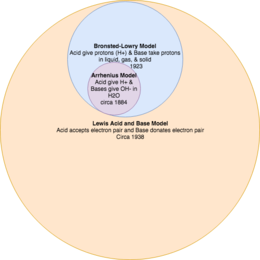
অম্ল-ক্ষার বিক্রিয়া তত্ত্বসমূহ সুপারসেট ও উপসেট মডেল রূপে।
অম্ল-ক্ষার বিক্রিয়া মডেলসমূহকে একে অপরের পরিপূরক তত্ত্ব হিসাবে ভাবা গুরুত্বপূর্ণ। [১] উদাহরণস্বরূপ, অম্ল ও ক্ষার কী সে সম্পর্কিত তার বিস্তৃত সংজ্ঞা প্রদান করে বর্তমান লুইস মডেলটি, যেখানে ব্রনস্টেড-লাউরি তত্ত্বটি অম্ল ও ক্ষারের সংজ্ঞা প্রদান করে এর একটি উপসেট হিসেবে
এবং আরহেনিয়াস তত্ত্বটি এক্ষেত্রে সর্বাধিক সীমাবদ্ধতা প্রকাশ করে।
অ্যালবুমিন এবং অম্ল বিক্রিয়া করে সাদা একটি অধঃক্ষেপ তৈরি করে । এই অধঃক্ষেপের ঘনত্ব পনির চেয়ে বেশি তাই এটি পনিতে ডুুুবে থাকে। অ্যালবুমিন এবং অম্ল খুব দ্রুুুত গতিতে বিক্রিয়া করে। বিক্রিয়ার অ্যালবুমিনের আয়তন বেড়ে যায়। এবং অ্যালবুমিন তরল থেকে কঠিনে রুপান্তর হয়।
অ্যালবুমিন এবং ক্ষার বিক্রিয়া করে সাদা রংয়ের একটি অধঃক্ষেপ তৈরি করে। অ্যালবুমিন ক্ষারের সাথে খুব ধীর গতিতে বিক্রয়া করে। অ্যালবুমিনের অধঃক্ষেপ পানির চেয়ে ঘন তাই পানিতে ডুবে যায়। অ্যালবুমিন ক্ষারের সাথে বিক্রিয়া করে তরল থেকে কঠিনে রুপান্তর হয়।
অম্ল-ক্ষার সংজ্ঞাসমূহ
ঐতিহাসিক বিকাশ
অম্ল-ক্ষার বিক্রিয়ার ধারণা সর্বপ্রথম ১৭৫৪ সালে গিলাইম-ফ্রেঞ্চোইস রৌয়েল দ্বারা প্রস্তাবিত হয়েছিল, যেখানে যিনি “ক্ষার” শব্দটি রসায়নবিজ্ঞানের ক্ষেত্রে ব্যবহার করেছিলেন যা এমন একটি পদার্থরূপে যা অম্লের সাথে বিক্রিয়া করে তাকে শক্ত রূপ প্রদান করে (লবণ হিসাবে)। [২]
ল্যাভয়সিয়ের অম্লের অক্সিজেন তত্ত্ব
অম্ল ও ক্ষারের প্রথম বৈজ্ঞানিক ধারণাটি প্রদান করেছিলেন অ্যান্টনি ল্যাভয়সিয়েল্যাভয়সিয়ে আনুমানিক ১৭৭৬ সালে । যেহেতু শক্তিশালী এসিড সম্পর্কে ল্যাভয়সিয়ের জ্ঞান প্রধানত সীমাবদ্ধ ছিল অক্সো এসিড পর্যন্ত যেমন HNO
3</br> HNO
3 (নাইট্রিক অ্যাসিড) এবং H
2SO
4</br> H
2SO
4</br> H
2SO
4 (সালফিউরিক অ্যাসিড) যা অক্সিজেন দ্বারা বেষ্টিত উচ্চ জারণ সংখ্যা বিশিষ্ট কেন্দ্রীয় পরমাণু ধারণ করে, এবং যেহেতু তিনি হাইড্রোহ্যালিক অ্যাসিডগুলির প্রকৃত গঠন ( HF, HCl, HBr এবং HI ) সম্পর্কে অবগত ছিলেন না, তাই তিনি এসিডগুলিকে অক্সিজেন ধারণকারী হিসেবে সংজ্ঞায়িত করেছিলেন , যা গ্রিক শব্দ থেকে প্রাপ্ত যার অর্থ “অ্যাসিড-প্রাক্তন” ( গ্রীক οξυς ( অক্সিজ থেকে ) যার অর্থ “অ্যাসিড” বা “ধারালো” এবং γεινομαι ( জিনোমাই ) যার অর্থ “এনজেন্ডার”)। ল্যাভয়সিয়ের সংজ্ঞা ৩০ বছরেরও বেশি সময় অবধি কার্যকর ছিল যতক্ষণ পর্যন্ত না ১৮১০ এর নিবন্ধ এবং স্যার হামফ্রি ডেভির বক্তৃতায় তিনি H
2S, H2Te,এবং হাইড্রোহ্যালিক এসিডে অক্সিজেনের অনুপস্থিতিকে প্রমাণ করেন। যাইহোক, ডেভি একটি নতুন তত্ত্ব তৈরি করতে ব্যর্থ হয়েছিলেন, এবং পরিশেষে এই সিদ্ধান্তে উপনীত হয়েছিলেন যে “অম্লতা কোনও নির্দিষ্ট প্রাথমিক পদার্থের উপর নির্ভর করে না, তবে বিভিন্ন পদার্থের অদ্ভুত বিন্যাসের উপর নির্ভর করে”। [৩] অক্সিজেন তত্ত্বের একটি উল্লেখযোগ্য পরিবর্তন জন্স জ্যাকব বার্জেলিয়াস দিয়েছিলেন, তিনি বলেছিলেন যে অধাতুর অক্সাইডসমূহ এসিড এবং ধাতুর অক্সাইডসমূহ ক্ষার।
লিবিগের এসিডের হাইড্রোজেন তত্ত্ব
১৮৩৮ সালে, জাস্টাস ভন লিবিগ প্রস্তাব করেছিলেন যে এসিড হল হাইড্রোজেনযুক্ত যৌগ যার হাইড্রোজেন একটি ধাতু দ্বারা প্রতিস্থাপিত করা যেতে পারে। [৪][৫][৬] এই পুনঃনির্ধারণটি জৈব অ্যাসিডের রাসায়নিক সংযুতি সম্পর্কে তাঁর ব্যাপক কাজের ভিত্তিতে এবং ডেভি দ্বারা শুরু হওয়া অক্সিজেন-ভিত্তিক অ্যাসিড থেকে হাইড্রোজেন-ভিত্তিক অ্যাসিডের মতবাদগত পরিবর্তনকে সমাপ্ত করে। লিবিগের সংজ্ঞা পুরোপুরি অভিজ্ঞতাবাদী হওয়া সত্ত্বেও আরহেনিয়াস সংজ্ঞা গ্রহণ না হওয়া অবধি প্রায় 50 বছর ধরে ব্যবহৃত ছিল। [৭]
আরহেনিয়াসের সংজ্ঞা

আণবিক পর্যায়ে অম্ল ও ক্ষারের প্রথম আধুনিক সংজ্ঞা প্রদান করেছিলেন সোভান্তে আরহেনিয়াস। [৮][৯] অম্লের হাইড্রোজেন তত্ত্ব, এটি জলীয় দ্রবণে আয়নের উপস্থিতি প্রতিষ্ঠায় ফ্রিডরিচ উইলহেলম অস্টওয়াল্ডের সাথে তাঁর ১৮৮৪ সালের কাজ থেকে শুরু করে ১৯০৩ সালে অ্যারেনিয়াসকে রসায়নে নোবেল পুরস্কার প্রদান করে।
আরহেনিয়াস দ্বারা সংজ্ঞায়িত:
- অ্যারেনিয়াস এসিড হল একটি পদার্থ যা জলীয় দ্রবণে বিয়োজিত হয়ে হাইড্রোজেন আয়ন (H+) গঠন করে;[৪] অর্থাৎ একটি এসিড জলীয় দ্রবণে H+ আয়নের ঘনমাত্রা বাড়িয়ে তোলে।
এটি পানির প্রোটোনেশন বা হাইড্রোনিয়াম (H3O+) ) আয়ন তৈরির কারণে হয়ে থাকে। সুতরাং, আধুনিক সময়ে H+ কে H 3O+ একটি সংক্ষেপে ব্যাখ্যা করা হয়েছে কারণ এটি বর্তমানে পরিচিত হয় যে একটি খালি প্রোটন জলীয় সমাধান একটি বিনামূল্যে প্রজাতি হিসেবে বিদ্যমান নয় হয়। [১০]
- অ্যারেনিয়াস ক্ষার হল এমন একটি পদার্থ যা পানিতে বিয়োজিত হয়ে হাইড্রোক্সাইড (OH−) আয়ন তৈরি করে; অর্থাৎ, একটি ক্ষার জলীয় দ্রবণে OH− আয়নের ঘনমাত্রা